非監督式神經網絡在癌症組織異質性中的應用——Faust algorithm
8 minutes隨著深度學習應用於病理影像的技術在近年愈發的成熟,其在病理影像分析中的應用也日益廣泛。然而許多模型仍仰賴於監督式學習,而標注數據需要大量的資料量和心力,在醫學影像領域尤其困難。在這情況下,Faust的團隊發表了一個由 RCC (renal cell carcinomas) 的組織學特徵訓練而成的非監督式模型,使深度學習能在病理學領域被更加廣泛的應用。
訓練資料來源
團隊從 TCGA (The Cancer Genome Atlas) 的開放資料庫中取了 550 張 H&E 染色的 RCC 患者 WSI(Whole slide image)影像用於訓練。RCC 的腫瘤影像用有較鮮明的物理結構特徵,因此很適合用於訓練初步模型。
特徵提取:VGG-19模型
團隊先是用 VGG-19 模型,利用了預先以 ImageNet 圖像集訓練好的初步權重進行特徵的提取。將最終池化層中所得到的特徵向量進行平均化後,他們發現這些特徵多能反應組織特徵,如纖維化、黏液、上皮組織等,且特徵的展現並不依賴腫瘤種類、病發階段或嚴重程度。
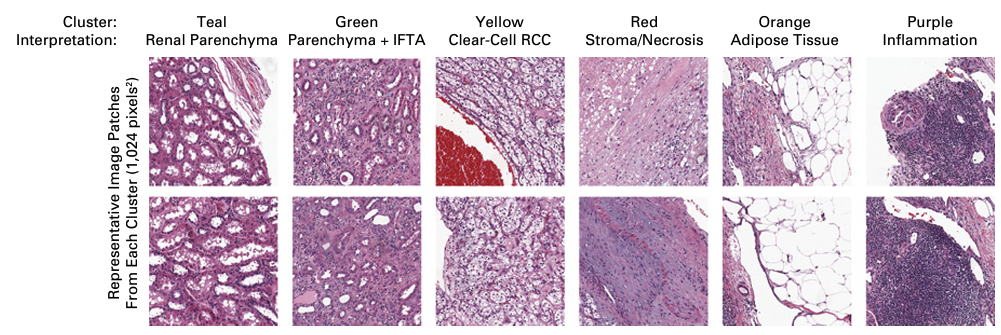
非監督式分群與分析
透過CNN提取了特徵向量後,接著以非監督的方式進行分群,這裡團隊使用了輪廓法(Silhouette Method) 確定了最佳的分群數量,並使用 Ward’s Minimum Variance Method 來進行層級聚類。除了大方向的影像分類,團隊也使用了 K-means作為細項的分類工具,並成功分類出不同的癌症亞種和一些臨床資料,如生存率等和影像資料間的關聯。
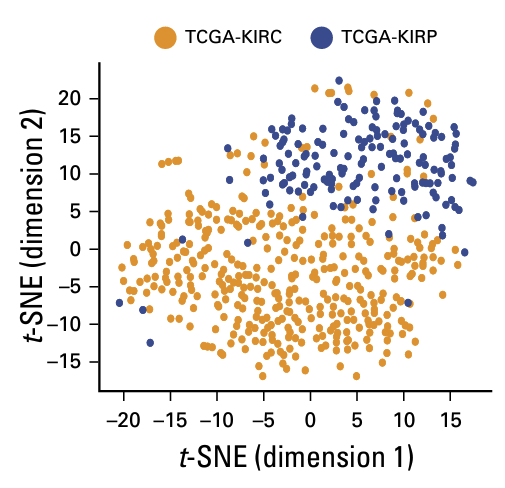
除了RCC外,訓練好的模型也擁有良好的泛用率,在模型未曾見過的子宮內膜癌和胰臟癌中也能成功地將組織分群。

除了組織學上的發現外,在把KIRC案例分群結果和預後資料進行分析時,發現不同群間的預後成效也不同。進一步的研究後發現,DLF值能一定程度的評估預後效果。

這項研究展示在無需監督標注的情況下,能夠有效地區分腎細胞癌與其他組織,並細分不同的RCC亞種及其臨床相關特徵,也能在其他未見過的癌症類型中泛化應用,為腫瘤異質性的探索提供了一個動態且客觀的框架。也展現出了能預測生存率的臨床應用價值。
參考資料
Kevin Faust et al.,Unsupervised Resolution of Histomorphologic Heterogeneity in Renal Cell Carcinoma Using a Brain Tumor–Educated Neural Network. JCO Clin Cancer Inform 4, 811-821(2020).
